DEFINICIÓN DE LA QUÍMICA
La definición de la química en las ciencias naturales hace que sea considerada la Ciencia Central. La química es de importancia en muchos campos del conocimiento, como la física, la ciencia de materiales, la biología, la medicina, la geología y la astronomía, entre otros.
Los procesos naturales estudiados por la química involucran partículas fundamentales (electrones, protones y neutrones), partículas compuestas (núcleos atómicos, átomos y moléculas) o estructuras microscópicas como cristales y superficies.
Química, del griego χημεία (khemeia que significa "alquimia") es la Ciencia Natural que estudia lamateria, su estructura,propiedades y transformación a nivel atómico, molecular y macromolecular.
Como ejemplos de reacciones químicas tenemos:
- El resultado de la colisión de una partícula alfa con el núcleo de un átomo, un átomo o molécula.
- La colisión de un neutrón libre con un núcleo atómico inestable. (Fisión nuclear)
- La formación de moléculas o iones a partir de la colisión de dos átomos.
- La fragmentación, ionización o cambio de estructura de una molécula después de ser irradiada con luz.
- La absorción de un átomo o molécula sobre una superficie.
- El flujo de electrones entre dos sólidos en contacto.
- El cambio estructural en una proteica ante el estímulo apropiado.
Desde el punto de vista microscópico, las partículas involucradas en una reacción química pueden considerarse como un sistema cerrado que intercambia energía con su entorno. En procesos exotérmicos, el sistema libera energía a su entorno, mientras que un proceso endotérmico solamente puede ocurrir cuando el entorno aporta energía al sistema que reacciona.
En la gran mayoría de las reacciones químicas hay flujo de energía entre el sistema y su campo de influencia, por lo cual podemos extender la definición de reacción química e involucrar la energía cinética (calor) como un reactivo o producto.
Es común que entre las comunidades académicas de químicos la química analítica no sea considerada entre las subdisciplinas principales de la química y sea vista más como parte de la tecnología química.
Otro aspecto notable en esta clasificación es que la química inorgánica sea definida como "química no orgánica". Es de interés también que la Química Física es diferente de la Física Química. La diferencia es clara en inglés: "chemical physics" y "physical chemistry"; en español, ya que el adjetivo va al final, la equivalencia sería:
• Química física <-> Physical Chemistry
• Física química <-> Chemical physics
Usualmente los químicos son educados en términos de físico-química (Química Física) y los físicos trabajan problemas de la física química.
SUBDISCIPLINAS DE LA MATERIA

- Química inorgánica: Síntesis y estudio de las propiedades eléctricas, magnéticas y ópticas de los compuestos formados por átomos que no sean de carbono (aunque con algunas excepciones). Trata especialmente los nuevos compuestos con metales de transición, los ácidos y las bases, entre otros compuestos.
- Química orgánica: Síntesis y estudio de los compuestos que se basan en cadenas de carbono.
- Bioquímica: estudia las reacciones químicas en los seres vivos, estudia el organismo y los seres vivos.
- Química física: estudia los fundamentos y bases físicas de los sistemas y procesos químicos. En particular, son de interés para el químico físico los aspectos energéticos y dinámicos de tales sistemas y procesos. Entre sus áreas de estudio más importantes se incluyen la termodinámica química, la cinética química, la electro-química, la mecánica estadística y la espectroscopia. Usualmente se la asocia también con la química cuántica y la química teórica.
- Química industrial: Estudia los métodos de producción de reactivos químicos en cantidades elevadas, de la manera económicamente más beneficiosa. En la actualidad también intenta aunar sus intereses iniciales, con un bajo daño al medio ambiente.
- Química analítica: estudia los métodos de detección (identificación) y cuantificación (determinación) de una sustancia en una muestra. Se subdivide en Cuantitativa y Cualitativa.
LA MATERIA
La materia es lo que forma todos los objetos que nos rodean. Una roca, una mesa, el aire o el agua están hechos de materia.
Una sustancia es cada tipo de materia. El hierro, el aire o el agua.
Todos los objetos tienen dos tipos de propiedades:
- Las propiedades generales.
- Y las propiedades específicas.
La propiedades generales son comunes a todo tipo de materia.
Las propiedades generales de la materia son: La masa y el volumen.
Las propiedades específicas son propias de cada tipo de materia y permiten distinguir unas sustancias de otras.
Algunas propiedades específicas son: el color, la dureza, el brillo, la transparencia.
MASA Y VOLUMEN
La masa es la cantidad de materia que tiene un objeto. Se mide en kilogramos.
El volumen es la cantidad de espacio que ocupa un objeto. Se mide en litros.
PROPIEDADES DE LA MATERIA
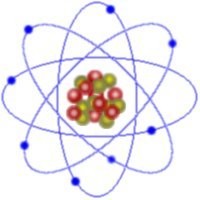
EL ÁTOMO

El átomo es la parte más pequeña en la que se puede obtener materia de forma estable, ya que las partículas subatómicas que lo componen no pueden existir aisladamente salvo en condiciones muy especiales. El átomo está formado por un núcleo, compuesto a su vez por protones y neutrones, y por una corteza que lo rodea en la cual se encuentran los electrones, en igual número que los protones.
Protón, descubierto por Ernest Rutherford a principios del siglo XX, el protón es una partícula elemental que constituye parte del núcleo de cualquier átomo. El número de protones en el núcleo atómico, denominado número atómico, es el que determina las propiedades químicas del átomo en cuestión. Los protones poseen carga eléctrica positiva y una masa 1.836 veces mayor de la de los electrones.
Neutrón
Partícula elemental que constituye parte del núcleo de los átomos. Fueron descubiertos en 1930 por dos físicos alemanes,Walter Bothe y Herbert Becker. La masa del neutrón es ligeramente superior a la del protón, pero el número de neutrones en el núcleo no determina las propiedades químicas del átomo, aunque sí su estabilidad frente a posibles procesos nucleares (fisión, fusión o emisión de radiactividad). Los neutrones carecen de carga eléctrica, y son inestables cuando se hallan fuera del núcleo, desintegrándose para dar un protón, un electrón y un antineutrino.
Electrón, partícula elemental que constituye parte de cualquier átomo, descubierta en 1897 por J. J. Thomson. Los electrones de un átomo giran en torno a su núcleo, formando la denominada corteza electrónica. La masa del electrón es 1836 veces menor que la del protón y tiene carga opuesta, es decir, negativa. En condiciones normales un átomo tiene el mismo número de protones que electrones, lo que convierte a los átomos en entidades eléctricamente neutras. Si un átomo capta o pierde electrones, se convierte en un ion.
Los científicos y el átomo
Ernest Rutherford, científico nacido en Nueva Zelandia, demostró en 1911 la existencia del núcleo atómico, complementando el conocimiento del electrón, descubierto en 1897 por J.J. Thompson. Desde entonces, múltiples experiencias han demostrado que el núcleo está compuesto por partículas más pequeñas, los protones y neutrones. Y en 1963, Murray Gell-Mann postuló que protones y neutrones están compuestos por partículas aún más pequeñas, a las que llamó "quarks".
La experiencia de Rutherford fue crucial en la determinación de la estructura atómica. Los párrafos que siguen son un extracto de su propia comunicación (1911):
"Es un hecho bien conocido que las partículas alfa y beta sufren desviaciones de sus trayectorias rectilíneas a causa de las interacciones con los átomos de la materia.
Parece indudable que estas partículas de movimiento veloz pasan en su recorrido a través de los átomos, y las desviaciones observadas son debidas al campo eléctrico dentro del sistema atómico.
Las observaciones de Geiger y Mardsen sobre la dispersión de partículas alfa, indican que algunas de estas partículas deben de experimentar en un solo encuentro desviaciones superiores a un ángulo recto.
Un cálculo simple demuestra que el átomo debe de ser asiento de un intenso campo eléctrico para que se produzca una gran desviación en una colisión simple..."
ESTADOS DE LA MATERIA

Es un conjunto de átomos iguales o diferentes, unidos por enlaces químicos, que
constituyen la mínima porción de una sustancia que puede separarse sin alterar sus propiedades.
Propiedades generales de la materia
Propiedades extrínsecas (extensivas o generales)
Son aquellas que varían con la cantidad de materia considerada, permitiendo reconocer a la materia, como la extensión, o la inercia. Estas son: peso,volumen y longitud.
Propiedades intrínsecas (intensivas o específicas)
.jpg) Son aquellas que no varían con la cantidad de materia considerada. No son aditivas y, por lo general, resultan de la composición de dos propiedades extensivas. Estas son: punto de fusión, punto de ebullición, densidad, coeficiente de solubilidad, índice de refracción, color, olor, sabor.
Son aquellas que no varían con la cantidad de materia considerada. No son aditivas y, por lo general, resultan de la composición de dos propiedades extensivas. Estas son: punto de fusión, punto de ebullición, densidad, coeficiente de solubilidad, índice de refracción, color, olor, sabor.
Sustancias: un tipo de materia con unas propiedades características bien definidas.
Las sustancias son siempre homogéneas excepto cuando cambian de estado.
Disoluciones: consta de dos componentes el so luto (componente que se encuentra en menor proporción) y disolvente ( componente en el que se disuelve el so luto.)
Otras propiedades de la materia:
La materia está en constante cambio. Las transformaciones que pueden producirse son de dos tipos:
- Físicas: son aquellas en las que se mantienen las propiedades originales de la sustancia, ya que sus moléculas no se modifican.
- Químicas: son aquellas en las que las sustancias se transforman en otras, debido a que los átomos que componen las moléculas se separan formando nuevas moléculas.
QUÉ ESTUDIA LA QUÍMICA?
1. La química estudia la composición, propiedades y transformaciones de la materia a nivel microscópico.
2. Analiza las partículas y las fuerzas que mantienen unida la materia en su micro estructura.
3. Aprovecha el conocimiento de las propiedades de una sustancia para identificarla o para utilizarla con unos fines concretos.
4. El aspecto más importante de la química es probablemente el estudio de las transformaciones de unas sustancias en otras, esto es, el estudio de las reacciones químicas: el porqué y el cómo ocurren estas reacciones.
FUNCIONES QUÍMICAS BÁSICAS

FUNCIÓN OXIDO
Concepto:
Los óxidos básicos se forman cuando el elemento que se combina con oxígeno es un metal.
Metal + Oxígeno = Óxido básico
2Ca + O2  2CaO
2CaO
 2CaO
2CaO
Como su nombre lo indica, los óxidos básicos sometidos a la acción del agua producirán compuestos de carácter básico o alcalino.
Formulación:
Para escribir directamente la fórmula:
-Escribimos los símbolos del metal y del oxígeno.
-Intercambiamos los números de oxidación sin el signo y lo escribimos como subíndices. Si es posible, simplificamos
Los óxidos son compuestos que resultan de la combinación del oxígeno con cualquier otro elemento. El oxígeno se combina fácilmente con la mayoría de los elementos de la tabla periódica. Agrupamos, entonces, a los óxidos en dos grandes categorías: óxidos básicos y óxidos ácidos, diferentes en cuanto a origen y características.
Óxidos Básicos o Metálicos
Nomeclatura: Óxidos Ácidos o Anhídridos
Concepto:
Los óxidos ácidos resultan de combinar con oxígeno un no metal. Los óxidos no
metálicos son gaseosos y al disolverse con el agua forman ácidos.
No metal + oxígeno = óxido ácido
Formulación:
La fórmula del óxido no métalico se escribe como la de un óxido metálico. Escribimos los símbolos del no metal y del oxígeno. Intercambiamos números de oxidación sin signos y los escribimos como subíndices. Si son pares, se simplifican.
Nomenclatura:
Para nombrarlos se antepone el nombre común anhídrido al nombre del no metal. Para diferenciar varios óxidos del mismo no metal, se usan los prefijos hipo- inferior e Per- superior y los sufijos -oso e -ico, como se muestra:
Función Hidróxido
Concepto:
Los hidróxidos, también llamados bases o alcális, se producen cuando los óxidos báscios o metálicos reaccionan con agua. Su grupo funcional es el radical oxidrilo o hidroxilo OH.
Óxido básico + agua = hidróxido
Na2O + H2O = 2NaOH
Los hidróxidos son fácilmente identificables:
-Viran el color del papel tornasol de rojo a azul, y la fenolftaleína de incolora a rojo grosella.
-Tienen sabor amargo, como el jabón o el champú. Pero como regla ¡no pruebes las sustancias químicas!
Formulación:
Para escribir las fórmulas de los hidróxidos procedemos de la siguiente manera:
-Escribimos el símbolo del metal seguido del radical oxidrilo OH.
-Intercambiamos los números de oxidación y los escribimos como subíndices. El número de oxidación del radical oxidrilo es -1.
-El radical oxidrilo se escribe entre paréntesis solo si requiere subíndices.
Nomenclatura:
Los hidróxidos se nombran con ese nombre genérico seguido por el nombre del metal correspondiente.
Si el metal tiene dos posibles estados de oxidación, sus hidróxidos terminan en -oso e -ico, respectivamente:
Fe(OH)2 Hidróxido ferroso
Función Ácido
Los ácidos son compuestos químicos que tienen al ion hidrógeno H* como grupo funcional. Las características que nos permiten reconocerlos son:
-Viran a rojo el papel tornasol azul.
-Tiene sabor agrio. Puedes experimentarlo con limón o vinagre nunca con ácidos de
laboratorio.
-Tienen olor penetrante e irritan la piel y mucosas.
-En soluciones acuosas, se disocian liberando iones hidrógeno (H*) o protones.
Existen dos clases de ácidos inórgánicos: Los ácidos oxácidos, que contienen oxígeno; y los ácidos hidrácidos, que no contienen oxígeno
Ácidos Oxácidos
Concepto:
Los ácidos oxácidos resultan de la combinación de un óxido ácido o anhídrido con agua.
Óxido Ácido + Agua = Ácido Oxácido
SO3 + H2O  H2SO4
H2SO4
 H2SO4
H2SO4
Para escribir la ecuación de formación de un ácido oxácido, partimos del óxido respectivo. Luego simplificamos los subíndices del producto para obtener la fórmula final del ácido acompañada del coeficiente que balancea la ecuación (¡exactamente como extraer múltiplo común!).
Cl2O + H2O  H2Cl2O2
H2Cl2O2 
 H2Cl2O2
H2Cl2O2 
2HClO
Nomeclatura:
Para nombrar los ácidos, de nuevo debemos tener en cuenta el número de oxidación del no metal. En la nomenclatura tradicional, el ácido se llama como el anhídrido que lo originó. Solo varía el nombre genérico de anhídrido a ácido, y se mantienen los prefijos y sufijos correspondientes.
Ácidos Hidrácidos
Concepto:
Los hidrácidos son ácidos no oxigenados porque no provienen de óxidos. Están formados por los metales de los grupos VI A o VII A de la tabla periódica e hidrógeno.
No Metal + Hidrógeno  Ácido Hidrácido
Ácido Hidrácido
 Ácido Hidrácido
Ácido Hidrácido
S + H2  H2S (ac)
H2S (ac)
 H2S (ac)
H2S (ac)
Formulación:
Para escribir su fórmula, escribe el símbolo del hidrógeno y el del no metal con número de oxidación negativo; -1 para los del grupo VII (ac) indica que el ácido permanece disociado en solución acuosa.
Nomenclatura:
Toman el nombre genérico ácido, seguido del nombre del no metal terminado en el sufijo -hídrico.
HCl Ácido clorhídrico
Función Sal Inorgánica
Las sales son compuestos iónicos sólidos y cristalinos a temperatura ambiente. Abundan en la tierra y en los océanos. Algunas son fundamentales para la vida.
Según el ácido que las originó, las sales pueden ser oxisales o sales haloideas. Algunos ejemplos del uso de las sales en el día a día: la sal común cloruro de sodio, adereza y preserva los alimentos. El mármol carbonato de calcio cristalino. La piedra caliza, las conchas de los moluscos, las perlas y el sarro de la tetera son básicamente la misma sal oxisal.
Sales Oxisales
Concepto:
Las Sales Oxisales se forman al reaccionar una base o hidróxido con un ácido oxácido.
Hidróxido + Ácido Oxácido 

Sal Oxisal + Agua
KOH + HNO3  KNO3 + H2O
KNO3 + H2O
 KNO3 + H2O
KNO3 + H2O
Nomenclatura:
El nombre del anión proviene del ácido que lo origina, pero se cambian los sufijos según las siguientes reglas:
-oso por -ito
-ico por -ato
Ejemplo:
Ácido nitroso + hidróxido de potasio = nitrito de potasio
KNO2 + H2O
Si, además el metal tiene dos estados de oxidación, su nombre termina en -oso e -ico, como en el hidróxido que originó la sal.
Ejemplo:
Ácido sulfúrico + hidróxido cúprico = sulfato cúprico
H2SO4 + Cu(OH)2  CuSO4 +
CuSO4 +
 CuSO4 +
CuSO4 +
2H2O
Sales Haloideas
Concepto:
Las sales haloideas se forman al neutralizar un ácido hidrácido con un hidróxido.
Hidróxido + Ácido Hidrácido = Sal Haloidea + Agua
NaOH + HCl  NaCl + H2O
NaCl + H2O
 NaCl + H2O
NaCl + H2O
Nomeclatura:
El anión se nombra cambiando el sufijo -hídrico del ácido del cual provienen por -uro. Si el metal tuviera dos estados de oxidación, termina en los sufijos -oso e -ico.
PbS = Sulfuro plumboso
PbS2 = Sulfuro plúmbico



.jpg)
.jpg)

.jpg)